











Es un microscopio que emplea una técnica mediante el seccionamiento óptico, de tal manera que permite incrementar el contraste y/o reconstruir imágenes tridimensionales. Al tener incorporado “pinhole” espacial es posible eliminar o reducir la florescencia fuera del plano focal en una muestra gruesa, consiguiendo de esta forma imágenes con mayor resolución y calidad.
Utilizando el microscopio confocal la muestra permanece intacta y el corte puede repetirse muchas veces. True Confocal Scanning (TCS) es una técnica en la que solo se ilumina y se observa un único punto limitado por difracción a la vez. El beneficio de las imágenes confocales es un contraste espectacularmente mayor al eliminar señal fuera del plano.
Las secuencias Z de cortes ópticos (pilas de imágenes 3D) son fuertes para la representación posterior como anáglifos, mapas codificados en profundidad o películas 3D.




La comprensión de dinámicas celulares complejas y/o rápidas es un paso importante para explorar procesos biológicos. Por lo tanto, la investigación actual en ciencias de la vida se centra cada vez más en procesos dinámicos como la migración celular, cambios morfológicos de células, órganos o animales completos y eventos fisiológicos en tiempo real (p. ej., cambios en la composición de iones intracelulares) en especímenes vivos. Un enfoque para abordar estas demandas desafiantes es emplear ciertos métodos ópticos que se denominan colectivamente imágenes de células vivas.
Las imágenes de células vivas proporcionan, en tiempo real, una “instantánea” del estado actual de una célula u organismo en su entorno nativo sin introducir artefactos típicos de la fijación. Estas capacidades hacen que la obtención de imágenes de células vivas sea una técnica necesaria para abordar cuestiones de biología celular, investigación del cáncer, biología del desarrollo y neurociencia.
En los últimos años, los avances sustanciales en electrónica, óptica y tecnología de marcadores fluorescentes han hecho que las imágenes de células vivas sean más versátiles y de fácil acceso para los científicos.
Lo más importante que debe tener en cuenta para su experimento es mantener su muestra viva y saludable durante la preparación de la muestra y la obtención de imágenes. Por lo tanto, es fundamental mantener la muestra en un entorno que se asemeje lo más posible a las condiciones fisiológicas, es decir, temperatura, pH, niveles de oxígeno y otros factores importantes.
La exposición de células vivas a la luz provoca fototoxicidad y cambios en la fisiología de la muestra, por lo que es posible que obtenga resultados que no se parecen a los que realmente suceden en un organismo sano. Para evitar la fototoxicidad tanto como sea posible, los microscopios de campo amplio suelen ser la tecnología preferida para obtener imágenes de especímenes vivos. Iluminan la muestra con dosis bajas de luz LED para excitar los fluoróforos y la adquisición de imágenes es más rápida que con otros métodos de microscopía, como la imagen confocal.
Cuando se toman imágenes de especímenes vivos, las proteínas fluorescentes suelen ser la herramienta elegida para marcar las estructuras de los especímenes donde ocurren los eventos que desea estudiar, ya que estas proteínas suelen ser menos tóxicas en comparación con otras etiquetas y evitan el problema de que los anticuerpos no puedan ingresar al células. La tecnología de proteínas fluorescentes se basa en un fluoróforo codificado genéticamente que se puede utilizar para el seguimiento de biomoléculas etiquetadas en células vivas, sus interacciones, etc. El uso de múltiples proteínas fluorescentes simultáneamente, conocido como imagen multicolor o multiplex, le permite observar múltiples estructuras y procesos celulares. en sincronía, brindando resultados fisiológicamente más relevantes y, por lo tanto, agregando contexto a las mediciones (p. ej., ensayos de muertos vivos con marcadores adicionales o haciendo experimentos de observación de vesículas multicolores).
Existe una amplia gama de técnicas de microscopía aplicadas a la obtención de imágenes de células vivas. A menudo, el crecimiento de las células, los agregados celulares o el movimiento celular se observa a lo largo del tiempo utilizando microscopios compuestos y métodos como el contraste de fase y el contraste de interferencia diferencial ( DIC ). Las imágenes de lapso de tiempo de especímenes más grandes, como embriones de pez cebra en desarrollo, generalmente se realizan con microscopios estereoscópicos o macroscopios.
Este artículo se centra en las técnicas de microscopía de fluorescencia que se han vuelto más prominentes en las últimas décadas. Esta breve descripción cubre los métodos cuantitativos de uso común, así como las técnicas de fotomanipulación, que se usan comúnmente con microscopios de campo amplio.
Dado que la composición de iones en el citosol de las células determina muchas funciones cruciales, como la excitabilidad de las neuronas, la transcripción de genes y el movimiento celular, solo por nombrar algunas, la regulación de los iones intracelulares en términos espaciales y temporales es de gran interés para la vida. investigación científica. La formación de imágenes de iones (calcio, cloruro, magnesio) es un método común que utiliza colorantes fluorescentes o proteínas especialmente diseñadas para cambiar su comportamiento de emisión tras la unión del calcio. Esto permite a los investigadores observar cambios dinámicos en las concentraciones de iones de las células. Además, es posible obtener imágenes de los niveles de pH o voltaje intracelular con tintes fluorescentes especiales. Una técnica especial para detectar cambios en los niveles de iones, niveles de pH o voltaje es la formación de imágenes radiométricas. Esto se refiere a un grupo de métodos que permiten una determinación exacta de los cambios en las células, por ejemplo.
La fluorescencia de reflexión interna total o TIRF es una técnica especial que se utiliza para observar eventos que se encuentran en o cerca de la membrana plasmática de una célula. Mediante el uso de un campo evanescente para la excitación de fluorocromos que solo penetra 60-250 nm en la célula, la microscopía TIRF proporciona una resolución z inigualable que permite obtener imágenes de eventos que ocurren en la membrana plasmática o cerca de ella, por ejemplo, el transporte de moléculas a la membrana plasmática . TIRF evita el problema de verse abrumado por las señales de fluorescencia de moléculas más profundas dentro de la célula.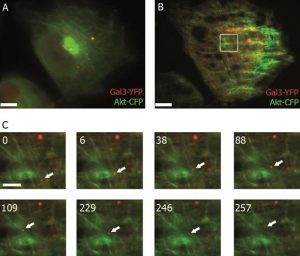

Figura 1: A) Imagen general con epifluorescencia. B) Imagen general con TIRF , la sección etiquetada se muestra en C. C) Secuencia de tiempo de una sección con TIRF (el tiempo se da en segundos). Una vesícula de galectina-3 (marcada con YFP) cerca de la membrana (flecha) se transporta primero a lo largo de un filamento de actina (de abajo hacia arriba), cambia a otro filamento (88 s), se mueve hacia la izquierda (109 s), se transportado nuevamente hacia la derecha, cambia nuevamente a otro filamento y luego es transportado hacia arriba (246 s). YFP: rojo; CFP: verde; escala de imágenes generales: 20 µm; espesor de sección: 6 µm; profundidad de penetración TIRF : 110 nm. Cortesía de Ralf Jacob, Universidad de Marburg, Alemania.
La transferencia de energía de resonancia de Förster o FRET pertenece a un grupo de técnicas de fotomanipulación que le permiten interactuar con el evento observado en la muestra mediante el uso de la luz.
FRET es una herramienta útil para cuantificar la dinámica molecular, como las interacciones proteína-proteína, las interacciones proteína-ADN y los cambios conformacionales de las proteínas. Las imágenes FRET normalmente usan derivados de GFP(proteínas fluorescentes verdes), en particular CFP e YFP (proteína fluorescente cian y amarilla, respectivamente), que se unen a proteínas de interés mediante métodos de biología molecular. Luego, la molécula de CFP se excita con luz fluorescente. Tan pronto como las proteínas de interés estén en estrecha proximidad espacial (<20 nm), la CFP actuará como donante y transferirá la energía que se emite en forma de luz a la YFP, que actúa como aceptor. El investigador observará un cambio de la fluorescencia azul emitida por el CFP a la fluorescencia amarilla emitida por el YFP. En el caso de BRET (transferencia de energía por resonancia de bioluminiscencia), el donante es una molécula bioluminiscente (por ejemplo, derivados de luciferasa) que actúa como donante y, como en FRET , un derivado de GFP actúa como aceptor.

Figura 2: Imagen confocal de células vivas de Arabidopsis; retículo endoplasmático: GFP marcado en verde, cloroplastos autofluorescentes en rojo y transmisión en azul. Usando una imagen de este tipo, por ejemplo, FRET o FRAP , se puede realizar el análisis.
La recuperación de fluorescencia después del fotoblanqueo ( FRAP ) es otra técnica de fotomanipulación que se usa a menudo para controlar el tráfico de proteínas o vesículas. FRAP utiliza una proteína fluorescente (generalmente GFP) unido a una proteína de interés, es decir, una proteína cuyo movimiento se va a controlar. Por lo general, toda la célula es inicialmente fluorescente ya que la proteína puede ser abundante en toda la célula. Luego, una determinada región de la célula, a menudo con estructuras celulares como axones o dendritas en las células neuronales, se expone a altas intensidades de luz para eliminar (blanquear) la fluorescencia en esa región en particular. A medida que la proteína de interés se mueve, aparecerá en la región blanqueada a cierta velocidad, que se puede rastrear con la señal fluorescente en recuperación de esta región, lo que brinda a los investigadores una idea de la dinámica del transporte intracelular.
La fotoactivación, un método desarrollado recientemente, marca de forma selectiva áreas de interés dentro de una célula u organismo mediante el uso de colorantes especialmente diseñados, como la proteína fluorescente verde fotoactivada (paGFP) o Kaede. Estos tintes solo muestran una fluorescencia significativa después de la iluminación con luz de una longitud de onda específica. Estos tintes también se pueden fusionar con una proteína de interés para estudiar su expresión o dinámica de transporte mediante FRAP o seguimiento de partículas.
Las imágenes de células vivas son una herramienta indispensable en la investigación de las ciencias de la vida que permite la visualización de las células en un estado lo más cercano posible al in vivo. La adquisición de imágenes de células vivas le permite comprender completamente y abordar sus preguntas de investigación sobre el movimiento celular, el crecimiento y los procesos dinámicos.
Se agradece la información de técnicas en células vivas a Leica:
https://www.leica-microsystems.com/science-lab/fluorescence-live-cell-imaging-techniques/
De altísima calidad, completamente motorizado y automatizado, permite el completo control del microscopio desde el software (eje z motorizado en el estativo, “revólver de objetivos” con platina convencional mecánica, Condensador, y epifluorescencia motorizados).
Las funciones motorizadas del microscopio pueden ser controladas desde el mismo estativo (paso de la luz, control del revólver, etc.) el cual posee 7 botones de libre programación para cualquier función. Iluminación transmitida con sistema de iluminación halógena de 100W con diafragmas de apertura y campo motorizados, revolver séxtuple completamente motorizado de alta estabilidad, posee ranuras para prismas de DIC (incluidos). Con torreta de filtros de 6 posiciones para cubos de filtros de fluorescencia completamente motorizado, cuenta con sistema “Zero píxel Shift” que asegura la perfecta alineación de las imágenes al cambiar de un cubo a otro. Es compatible con técnicas de contraste de campo claro y Nomarski-DIC. Incluye cabezal binocular, controlador CTR 5500, control de intensidad de epi-fluorescencia, puerto lateral derecho preparado para aceptar una cámara digital para microscopía, platina mecánica XY de grandes dimensiones, condensador S1/S28, aceite de inmersión, kit de seguridad para trabajo con láseres. Compatible con objetivos desde 1,25X a 100X Cuenta con una pantalla LCD de alta resolución que muestra toda la información correspondiente al sistema en uso situado en la base del microscopio.
Adaptador universal compatible con 6 tipos distintos de placas de cultivo (placas Petri de 24-68 mm de diámetro) y láminas de vidrio (porta-objetos de 24-120 mm) con 2 brackets móviles con un rango de fijación variable. Acoplable a platina mecánica XY incluida en la configuración.
El equipo viene con dos mesas. Una mesa funciona como un escritorio para el Control Panel, teclado, monitor y mouse. La segunda mesa es una mesa antivibratoria para el microscopio y el escáner. La mesa antivibratoria es pasiva con una losa de granito y un sistema para absorber las vibraciones del piso.
La fuente de luz externa para fluorescencia, Leica EL6000, permite utilizarse en microscopios upright, invertidos y estereomicroscopios. Posee un sistema conductor de la luz mediante una fibra óptica líquida flexible, que permite eliminar el calor, manteniéndolo lejos de la muestra y del estativo. No requiere la alineación de la lámpara, manteniendo el equipo siempre en la configuración óptima y ahorrando valioso tiempo.
Posee una lámpara de Haluro de Metal de larga duración, más de 2000hrs, silencioso, Shutter rápido, en menos de 6 milisegundos detiene la luz, para evitar el agotamiento de los fluorocromos. Incluye un atenuador de la intensidad de luz para evitar el desgaste de fluorocromos y el estrés en muestras vivas.
Se incluyen 2 oculares HC PLAN 10x/25 Br., filtros para fluorescencia, para excitación en el rango azul (FITC, GFP), verde (TRITC, CY3) y UV típico para DAPI/Hoechst (cod. 15513873).
Cambio automatizado y también mediante un botón entre los modos de campo amplio y confocal.
La óptica Plan Fluotar de Leica es recomendada para aplicaciones de fluorescencia estándar dado que está corregida ópticamente para este tipo de aplicaciones.
La óptica Plan Fluotar de Leica es recomendada para aplicaciones de fluorescencia estándar dado que está corregida ópticamente para este tipo de aplicaciones.
15506144 Obj. HCX PL FLUOTAR 40x WD 0.40 mm.
La óptica Plan Fluotar de Leica es recomendada para aplicaciones de fluorescencia estándar dado que está corregida ópticamente para este tipo de aplicaciones. Este es un objetivo compatible con el trabajo con cubreobjetos de 0,17 mm.
La óptica Plan Apocromática de Leica posee una corrección superior en los distintos colores del espectro visible lo que hace de ella una excelente óptica para aplicaciones de colocalización en fluorescencia y optimizada para aplicaciones de microscopía confocal. Este objetivo debe ser usado con aceite de inmersión.
Set de prismas localizados en el condensador compatibles con diversas magnificaciones mod. IC-Prism K11, K6, K3 y K10 (cod. 15521529, 15521521, 15555017, 15521524).
El nuevo fotomultiplicador PMT R9624 para el sistema SP tiene mayor sensibilidad y menos ruido con baja corriente oscura. Detectores de “32 canales” son bien conocidos por su baja sensibilidad en la región roja. El PMT R9624 es utilizable en todo el espectro visible (400-800nm).
El sistema de detección espectral patente de Leica Microsystems contiene un prisma, para asegurar el máximo de sensibilidad. El diseño del sistema está optimizado para detectar la luz que transmite el pinhole. La transmisión del prisma es aproximadamente de 95%.
El sistema permite cada canal espectral con su propia ganancia. Por lo tanto, se puede hacer capturas de múltiple marcaje y hacer un balance de las señales detectadas (en la imagen en vivo) para optimizar cada marcador independientemente. Sistemas de “32 canales” tienen un detector con 32 ánodos, los cuales tienen la misma ganancia y utilizan matemática y muestras de control para separar los fluorocromos correctamente, además tienen menor sensibilidad particularmente en el rango rojo.
El sistema de microscopía confocal espectral Leica TCS SP8 tiene la posibilidad de 5 canales espectrales internos (máximo en el mercado).
El sistema permite hacer escaneos de lamda, xλ, de alta resolución (1nm) y alta sensibilidad para por ejemplo identificar curvas de emisión de fluorescencia.
Fotomultiplicador (PMT) dedicado a la detección y adquisición de imágenes de luz transmitida mediante escaneo láser a través de la técnica de contrastación Nomarski-DIC con la que viene equipado el equipo. Incluye shutter motorizado.
La velocidad de escaneo es programable por el usuario entre 1-1800Hz (líneas por segundo) o 3600Hz en modo de escaneo bi-direccional con el scanner convencional (incluido) hasta 7 fps en modo 512x512 pixeles y 84 fps en modo 512x16 pixeles.
El escáner usa el diseño de X2Y de Leica Microsystems logrando el mayor campo de escaneo en mercado confocal, de 22mm. El diseño usa 3 espejos manejados por galvanómetros: 1 espejo para la dimensión X y 2 espejos para la dimensión Y. Este diseño es único y asegura mayor luminosidad en los bordes de la imagen e imágenes sin artefactos (que pueden estar en los bordes de otros tipos de escáneres).
El campo de escaneo tiene 22mm que es 2mm más que los equipos más cercanos y proporciona al usuario la posibilidad de ver más área de la muestra sin movimientos de una platina en XY. Este beneficio es importante en estudios de morfología y muestras grandes.
El formato de la imagen puede tener 8.192x8.192 píxeles de resolución de escaneo. Es decir, 64 millones de píxeles.
El sistema posee un zoom de hasta 48x. Este zoom es un aumento óptico. Para aumentar la magnificación de imagen, el área de escaneo disminuirá con el mismo formato en la pantalla. Además posee un zoom digital en el software.
Estación de trabajo de alto rendimiento, cuenta con un procesador Intel Xeon Quad core E51620 3,6 GHz, 8 Gbyte de memoria RAM, un disco duro de 2 TB SATA, tarjeta de video NVIDIA Quadro de 1Gb, grabador de DVD doble capa de 16x, tarjeta controladora 10/100/1000 Ethernet, teclado, mouse, sistema operativo Windows 7 64-bit, monitor LCD 30” true color 2560x1600.
El software LAS AF (Leica Application Suite Advanced Fluorescence) es una plataforma fácil de usar y compatible con todos los equipos avanzados para experimentos de fluorescencia avanzada de Leica Microsystems. El software base tiene 4 carpetas principales: configuración, adquisición, procesamiento, y cuantificación. Además hay módulos extras que para análisis o procesamiento avanzado. Permite el control de todos los componentes motorizados del microscopio confocal y la adquisición multidimensional de imágenes, procesamiento y cuantificación de las imágenes.
Poderoso paquete de algoritmos basados en el software AutoQuant para deconvolución de imágenes confocales. 158003206 Módulo de software Microlab (incluido) es el módulo para los wizards de FRET AB, FRET SE, FRAP, FRAP XT, FLIP, PA, etc.
Los wizards proveen protocolos para hacer experimentos complejos paso por paso desde la adquisición hasta el análisis. Los wizards facilitan y controlan el software para facilitar su uso.
Panel de control programable con 6 perillas y una pantalla LCD cada una para control en tiempo real de parámetros relevantes en el sistema confocal. Cada panel es programable desde el software del microscopio confocal.
Para el microscopio invertido DMI6000 con apertura redonda y/o rectangular para la observación. Provee temperatura a las placas durante un experimento de time-lapse para que las células puedan seguir sus procesos moleculares a una temperatura fisiológica.
Unidad de control con 1 canal para calefaccionar eléctricamente varios componentes. Resolución de temperatura desplegada en pantalla de 0,1°C. Resolución interna de 0,01°C. Rango de temperatura programable desde 0,0 hasta 60°C.
Teléfono: (55) 22513506



